目 次INDEX
オゾンとは何か
オゾン(OZONE)は、ギリシャ語のOzein(臭う)からきた、青臭い特有の刺激臭をもった気体の名称で、紀元前からその存在が知られていたと言われます。オゾンは、地球に到達した紫外線や雷の放電の際などに作られて、地球上の自然環境にも存在しますが、地上から約30Km上空にある成層圏にオゾン層と呼ばれる10 ~20ppmの濃度の層があって地球を囲んでバリヤーを形成しています。 このバリアは、太陽から発する強い紫外線の約95%を吸収して、地上への紫外線の到達を妨げているのです。もし、このオゾン層がなかったら、この地球上に動植物はおろか菌1個も生存できないと言われています。これは紫外線の中には殺菌線と呼ばれる強い殺菌力を持った波長の光が存在するからです。
地球上の生物は先ず水中で生まれ、海で生育した植物が光合成で酸素を発生し、これが紫外線に当たってO2⇒O3 になってオゾン層が形成されてから、陸上に上がったものと考えられておりますが、オゾン層の形成には、数十億年を要したとされています。
自然環境の身近なところでは、照り返しの強い海岸で日中0.1ppm~0.3ppmのオゾンが測定された報告もあります。通常の大気中では0.005ppmのオゾンが存在し、大気の自浄作用(殺菌・脱臭・脱色など)をしています。
地球上の生物は、すべてその大気を呼吸して生存していますが、エアコンや冷凍機の冷媒、整髪剤などのスプレーとして使われていたフロンガスや窒素酸化物、成層圏を飛ぶ超音速航空機、スペースシャトルの排気、核実験等によって、このオゾン層が破壊され、南極、北極上にはオゾン濃度の希薄なホールが出来ており、更に拡大の様相を呈しています。
このようなことから地上に到達する紫外線の量が多くなり、皮膚ガンの発生、動植物の突然変異の増加、農作物の被害、気象変動など様々な現象の要因となってきて、世界的に大きな地球環境問題となっていることは、ご存知のとおりです。
オゾンの物理的・科学的特徴
オゾンは酸素(O2)の同素体(同一種類の元素で出来ているのに構造が互いに異な る物質を同素体と言います)で、分子記号はO3、分子量は48、沸点-112℃、融点-193℃、臨界温度-12℃、比重は空気の1.54倍、酸素の3倍と重いですが、塩素よりは軽いものです。水への溶解度は塩素ほどではありませんが、酸素の約10倍と(0.57g/L 気温20℃の時)高い溶解度を示します。殺菌力は、天然元素の中ではフッ素に次いで高く、空気中では塩素の約1.65倍、水中では約7倍と言われています。
オゾン(O3)は非常に不安定な気体であるため、生成されたオゾンは常温で徐々に分解して、安定した酸素(O2)になります。第三の原子(O)の結合がゆるいために、容易に1原子の酸素(O)を放出するので、酸化力が強く、有機物、無機物を酸化します。また、微生物(細菌、真菌など)、臭気物質にも作用して、殺菌、脱臭、色素類の脱色もします。
オゾンは、通常の反応によって、毒性のある副次物を生成しないことから二次公害の心配がないこと、原料は空気または酸素であるので、どのような場所でも随時任意の量が得られることなどの利点があり、近年は工業用オゾン発生装置の開発により上・下水処理、医療、居住域や食品製造工程での殺菌・脱臭、食品の原材料の処理、貯蔵に利用されるようになってきております。
オゾンの発生方法
先にオゾンは紫外線や雷の放電によって生成されると述べましたように、オゾンを発生させる方法にはいくつかの方法がありますが、主な方法には次のものがあります。
光化学反応法
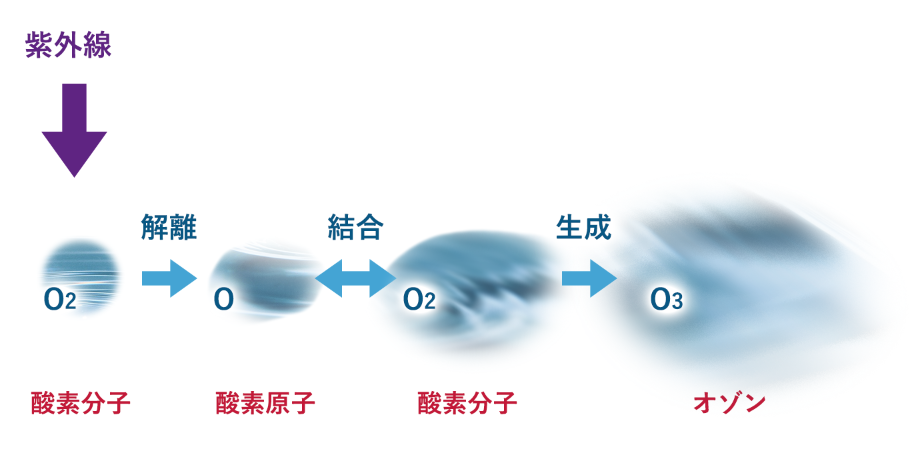
この方法は、オゾン層におけるオゾン生成のメカニズムと同じ原理です。つまり、紫外線の中でも更に波長の短いオゾン発生線とよばれる光線を酸素分子(O2)に照射すると、酸素分子(O2)が解離して酸素原子(O)が2個生じます。この酸素原子(O)が他の酸素分子(O2)と結合してオゾン(O3)が生成されるのです。
O2+O=O3
一般に紫外線によるオゾンの生成には紫外線ランプが使用されますが、この方法の難点としては、紫外線の中にはオゾンを生成する波長の光線と、オゾンを分解する波長の光線があるために、オゾンの生成と分解の反応が並列して起こること、さらに分解反応で生じた酸素原子(O)がオゾンと反応してオゾンを壊すという現象が起こるために、あまり高濃度なオゾン発生は期待できないと言われています。
身近なところではコピー機のランプから出る紫外線によって微量のオゾンが発生している例があります。このことからオゾンの臭いをコピー臭とよんでる文献もあります。森林や海岸にオゾンが多いのは、紫外線が強いためと言われています。
紫外線について
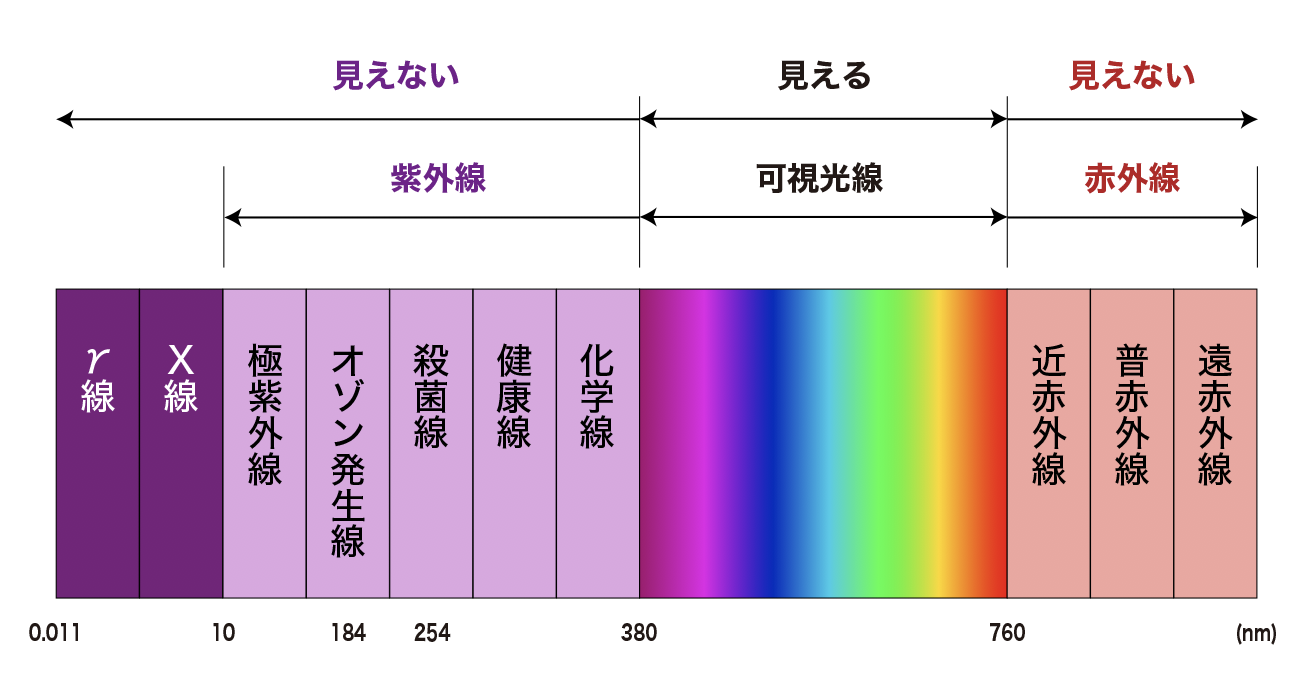
人間の目に見える光の中で最も波長の短いものが紫色です。紫色より短い波長の光を紫外線と言います。
紫外線は波長の種類によって異なった性質があり、それぞれが重要な働きがあります。
・250nm~260nm(ナノメーター)の紫外線に強力な殺菌効果
・185nmの紫外線は酸素を解離するためにオゾンの生成に寄与する効果
・254nmの紫外線はオゾンの分解に作用します。
nm(ナノメーター)は、1兆分の1mです。因みに千分の1mは1mm(ミリメーター)、百万分の1mは1μm(マイクロメーター)です。
電解法
この方法は電解液として硫酸または塩酸の水溶液を使用し、電気分解によってオゾンを生成するものです。最近の電解式オゾン発生法としては、固体電解質を使用する方法や4弗化ホウ酸を電解液に使用する方法などが研究されています。この方法は水を用いるため、窒素酸化物(NOx)を副次的に生成することがないという特長があります。大きな電源装置が必要であり、可搬性はありません。
放射線照射法
この方法は、放射線の電離作用によるもので、放射線の高エネルギー領域に空気を入れるとオゾンが発することを応用したものです。研究室段階のもので、実際のオゾン発生装置としては実用化されるまでには至っおりません。
放電によって発生させる方法
放電によってオゾンを発生させる方法としては、無声放電方式によるもの、コロナ放電方式によるもの、またはいくつかの放電方式を組み合わせた複合放電方式があります。
オゾンジェネレーターは、コロナ放電よりも電圧を抑え、パルスパワー を用いたストリーマ放電方式を採用しています。この製品の特長は、従来製品のコロナ放電と比べて消費電力が少なく、窒素酸化物の副次的な生成を著しく少なくしたこと、更に電極の寿命を、従来の製品が約3,000時間であるのに対し、約10,000時間と 飛躍的に長寿命化し、地球環境にやさしいことです。
オゾンの分解方法
残存オゾンを分解する方法としては、主に下記の方法が挙げられます。
活性炭吸着分解法
活性炭を用いて吸着分解させる方法で、オゾンを確実に処理でき、メンテナンスは活性炭の取り替えのみで済みます。吸着されたオゾンは活性炭と反応してCO2および少量のCOを生成します。この反応は、活性化エネルギーが大きいために、反応速度が遅く、活性炭表面にオゾンが蓄積されます。オゾンは発熱反応により分解してO2になります。
2O3 → 3O2 +286KJ
この方法は有機物の混入に極めて敏感であり、活性炭表面にオゾンが蓄積すると、比較的低温でも有機物が燃焼するので、活性炭層の温度管理が重要であると言われています。この方法は主として上下水道などで用いられている方法です。
加熱分解法
オゾンの分解は発熱反応であるので、活性エネルギー以上のエネルギーを与えられると、オゾンは熱分解を起こします。オゾンの分解には、温度と酸素濃度が影響し、温度の上昇とともに分解速度が速くなります。なお、オゾンの分解速度は光照射によっても加速されますが、200℃以上になると分解反応の半減期は数秒以内になります。実用的には、350℃に1秒間程度滞留させることにより、ほぼ完全に分解されると言われています。
接触分解法
シリカ(SiO2)、アルミナ(Al2O3、酸化第二鉄(Fe2O3)の表面でオゾンが接触分解することは古くから知られていて、地表付近のオゾンの分解は、土砂に含まれるこれらの成分が関与しているものと考えられています。このようにオゾンは種々の金属および金属酸化物の表面で分解して酸素になります。一般にこの反応は熱分解よりも低温で起こるので、コスト的に有利であり最も広く用いられています。触媒としては、二酸化マンガン(MnO2)、酸化第一鉄(Fe2O2)、酸化ニッケル(NiO)などが用いられています。これらを50℃~150℃程度に加熱してオゾンガスを通すと接触時間0.5~5秒程度で分解反応が行われます。
湿式法
(1)水洗法
水中に溶存したオゾンは非常に不安定で、十数分で半減すると言われています。また、温度上昇、PH値の上昇に伴って、加速度的に酸素へ分解します。水中におけるオゾンの分解は、水酸イオン(OH-)による塩基触媒反応によるものとされていますが、そのメカニズムは明解ではありません。ただし、中性の水の中ではオゾンの溶解速度が比較的遅いために、中性の水で洗浄しただけではオゾンの除去率が小さくなり、0.1ppm以下に除去することは難しいとされています。
(2)薬液洗浄法(アルカリ洗浄法)
水中におけるオゾンの分解速度はPH値が大きいほど速いので、高濃度のアルカリ水溶液の中では、非常に速やかに分解します。アルカリ水溶液としては、5%程度の水酸化ナトリウム(NaOH)が適当であります。この方法では、オゾンの分解生成物は酸素と水であるために、原理的にはアルカリ溶液の組成は反応の前後で変化しないので、循環して利用されます。ただし、この反応は炭酸イオンによって阻害されるため、溶液中に炭酸イオンの濃度が2%を超えるとオゾンの分解速度は急激に低下すると言われています。
(3)薬液還元法
還元性薬剤溶液による還元処理であり、価格の点から亜硫酸ナトリウムなど安価な還元剤溶液が用いられています。
?※アルカリ洗浄法、薬液還元法などは、高濃度のオゾンを含む排気ガスの処理に用いられるもので、気液接触装置、薬液循環ポンプ、薬液タンクおよびこれらを接続する配管設備が必要であり、装置が複雑であるばかりでなく、可動部分が多いのでメンテナンスも高価になります。
オゾンゼネレータに使用しているオゾンイレーサーは、アルミナ(Al2O2)、シリカ(SiO2)の混合物にオゾンを接触させて分解する触媒法を採用し、ほとんど瞬時にオゾンを分解しています。
オゾンの用途について
脱臭・脱色・環境改善
脱臭を目的として、オゾンは食品関係ばかりでなく、下水道、し尿処理、浴室、病院、老人施設、畜産、水産関係などでも利用されています。オゾンによる脱臭は、悪臭成分の酸化分解と、オゾンの臭気成分との中和作用によって脱臭します。
臭いの成分が何であるかによってオゾンで脱臭できるかどうかが決定されますが、食品工場などで発生する臭いは微生物に由来するものが多いので、殺菌と脱臭が同時に行われる場合もあります。オゾンは一般に、-SH、=S、-NH2、=NH、N、-OH、-CHO基を有する化合物との反応性が大きく、臭気成分の多くはこれらの基を持つためにオゾンによる脱臭が効果的なのです。なお、脱臭には、水中の臭気物質を除去する場合と大気中の臭気成分を除去する場合があります。
オゾン水の脱臭効果の例
| 成分 | 原臭濃(ppm) | 除去率(%) |
| 硫化水素 | 0.03 | 54 |
| 硫化水素 | 0.27 | 97 |
| メチルメルカプタン | 0.01 | 72 |
| メチルメルカプタン | 0.03 | 92 |
| 硫化メチル | 0.01 | 88 |
| 二硫化メチル | 0.02 | 65 |
| アンモニア | 0.04 | 98 |
| アンモニア | 0.33 | 91 |
| トリエチルアミン | 0.02 | 80 |
オゾン濃度6.0~7.8ppm+活性炭
下表は各種の酸化剤を用いて、天然水中の腐食質成分であるフミン酸による着色に対する最高脱色性能を比較したものです。オゾンが最も高い脱色性を示すことが分かります。
各種酸化剤の脱色性比較例
| 試料 | 色度(※1) | |||
| 未処理 | 処理後 | |||
| CL2 | CLO2 | O3 | ||
| A | 240 | - | 8 | 0 |
| B | 352 | 98 | 14 | 0 |
| C | 156 | 72 | 10 | 0 |
| D | 108 | 30 | 3 | 0 |
※1.?色度とは、1Lの水の中に白金1mg、コバルト0.5mgが含まれている場合の黄褐色の色の強度を1度として表わしたもので、水道水は5度以下でなければならないとされています。
| 試料 | COD(mg/L)(※2) | |||
| 未処理 | 処理後 | |||
| CL2 | CLO2 | O3 | ||
| A | 2,800 | - | 750 | 0 |
| B | 1,394 | 1,060 | 80 | 0 |
| C | 996 | 118 | 40 | 0 |
| D | 1,316 | 408 | 120 | 0 |
※2.?COD(Chemical Oxygen Demand:化学的酸素要求量)とは、検水に酸化物を加えて一定時間反応させ、消費された酸化剤の量を酸素に換算してmg/Lで表わすもので、水中の被酸化物量(主として有機物)の指標とされます。
殺菌・減菌
微生物に対するオゾンの殺菌作用は次のように言われています。
- オゾンが細胞壁または細胞膜に作用し、次いで脂質の二重結合に反応が生まれ、細胞が分解される。
- 微生物細胞の表面にオゾンが作用する。
- 微生物酵素が酸化する。
- 細胞壁にオゾンが作用し、細胞透過率に変化が生じ、細胞が分解する。
また、オゾン殺菌の特徴としては、
- 栄養細胞は比較的簡単に殺菌できるが、胞子形成菌はより抵抗性を持っている。
- 好気性胞子形成菌の方が嫌気性胞子形成菌よりもより容易に殺菌される。
- 気中や水溶液中の微生物に対する殺菌効率は、接触時間、濃度、水温、PH、無機物および有機物の存 在量に著しく影響される。
- 水溶液中のオゾンの殺菌力は乳酸菌に対して最も強く、次いで酵母類である。
- 低PH、低水温ほど殺菌力は増大する。
などが挙げられます。
オゾンによる殺菌は、簡単に言えば溶菌といわれ、塩素が細菌の細胞壁を通して拡散し、酵素を侵し、結果として死滅させる作用とは基本的に異なり、細菌の細胞壁の破裂、又は分解によるものなのです。
水中でのオゾンによる細菌の殺菌についての実験報告が多く発表されています。例えば大腸菌の場合、塩素では濃度0.1~0.2mg/Lで不活性化するのに対し、オゾンでは0.02~0.042mg/Lで不活性化すると言われています。このことは、オゾンは塩素の約1/10程度の低濃度でも有効であることを示しています。
また、O157大腸菌、ブドウ球菌、サルモネラ菌などについても同様な結果が得られます。
オゾン水と各種殺菌剤との効力比較例
99%不活性化CT値(mg/L・min)
| 殺菌剤 | 腸内細菌 | ウィルス | 芽細胞 | アメーバシスト |
| オゾン水 | 0.01 | 1 | 2 | 10 |
| 次亜塩素酸 | 0.2 | 5 | 100 | 100 |
| 次亜塩素酸イオン | 20 | 200 | 1,000 | 1,000 |
| モノクラミン | 50 | 1,000 | 5,000 | 200 |
※?CT値は、C=濃度(mg/L)とT=接触時間(min)の積で表わします。つまり、細菌を不活性化させるには、オゾン等の濃度が高ければ短い時間ですみ、濃度が低ければ長い時間を要するということです。
ここで留意すべきことは、オゾンの水への溶解度は最大でも570mg/L (20℃)であること。オゾン発生装置からオゾン水生成装置やエゼクタを通してオゾンを水に溶解させる場合でも、オゾン発生量の5%程度が水に溶解し、残りはほとんど大気中に放散してしまうことです。汎用オゾンゼネレータのオゾン発生量は100mg/H(MAX)ですが、その5%程度の約5mg/H(約0.08mg/min)が、水に溶解するものと理解しておくことが必要です。
病原性細菌に対するオゾンの殺菌作用の例
| 病原性細胞の種類 | オゾン濃度(ppm) | PH等 | 温度(℃) | 作用時間(分) | 死減率(%) | 気・液 |
| 黄色ブドウ球菌 | 0.5 | - | 25 | 15 | 100 | 液 |
| ネズミチフス菌 | 0.5 | - | 25 | 15 | 100 | 液 |
| フレクスなー赤痢菌 | 0.5 | - | 25 | 15 | 100 | 液 |
| 大腸菌 | 0.5 | - | 25 | 15 | 100 | 液 |
| 大腸菌 | 0.01 | 7.0 | 25 | 1 | 100 | 液 |
| 大腸菌 | 0.19 | - | 28 | 5 | 100 | 液 |
| 大腸菌 | 0.53 | 6.8 | 1 | 1 | 100 | 液 |
| 大腸菌 | 0.072/min(1通気量) | 下水 | - | 30 | 100 | 液 |
| 大腸菌 | 0.144/min(1通気量) | 浴場 | - | 10 | 100 | 液 |
| 霊菌 | 1.00 | - | - | 5 | 100 | 気 |
| 霊菌 | 0.6 | 寒天平板塗末法 | 13 | 60 | 100 | 気 |
| 大腸菌 | 0.6 | 寒天平板塗末法 | 13 | 30 | 100 | 気 |
| 尋常変形菌 | 0.6 | 寒天平板塗末法 | 13 | 15 | 100 | 気 |
| ネズミチフス菌 | 0.6 | 寒天平板塗末法 | 13 | 60 | 100 | 気 |
| 緑膿菌 | 0.6 | 寒天平板塗末法 | 13 | 60 | 100 | 気 |
| 蛍光菌 | 0.6 | 寒天平板塗末法 | 13 | 60 | 100 | 気 |
| 大腸菌 | 0.5 | 紙塗末法 | 5 | 60 | 100 | 気 |
| 大腸菌 | 0.5 | 紙塗末法 | 5 | 30 | 100 | 気 |
| 大腸菌 | 0.5 | 紙塗末法 | 5 | 10 | 100 | 気 |
食品加工工場などでは、後で述べますように昼間の作業時間中は、オゾンの室内雰囲気濃度は作業をする人の安全を保つために0.1ppm以下に止めますが、作業をしていない夜間はオゾンの濃度を高めて、殺菌力を高めます。その濃度の目安はおよそ下記の通りです。
| 室内雰囲気濃度 | 吹き出し時間 | |
| 加工場の夜間殺菌 | 0.3~20ppm | 30~60分 |
| 加工場の昼間殺菌 | 0.05~0.1ppm | 〃 |
| 冷蔵庫の夜間殺菌 | 0.5~20ppm | 〃 |
| 冷蔵庫の昼間殺菌 | 0.1~0.25ppm | 〃 |
期待されるオゾンの利用と効果
オゾンは先に述べましたように、その殺菌・脱臭・脱色などの効果から、種々の分野でこれの利用と効果が期待されています。以下にこれについてまとめてみました。(コロナウイルス予防対策)
| 利用場所 | 期待される利用効果 |
|---|---|
| 病院 | 医者・看護婦・患者の手洗い場、共同トイレ、浴室の殺菌。病室、汚物処理、ゴミ置き場の脱臭、病院内二次感染の予防。 |
| 会議室 | タバコ、体臭の脱臭。 |
| ホテル客室 | 客室、廊下、ロビーの脱臭。 |
| 飲食店 | トイレの脱臭。厨房、ストックヤードの除菌。食材のオゾン水洗浄状による雑菌。 |
| ペットショップ | 店内、排泄物の脱臭。店内殺菌によるペットの病害の防止。店のイメージアップに効果。 |
| カラオケBOX | BOX内の脱臭。マイクの殺菌。店のイメージアップに効果。 |
| クリーニング | 廃棄汚水の分解浄化による水の再利用。経費節減、エコロジーに貢献。 |
| 食品加工工場 | 加工工場の殺菌、脱臭。冷蔵庫の殺菌、脱臭。加工食品のオゾン水洗浄による殺菌。オゾンガス封入包装による殺菌。豆腐の冷水除菌。 |
| スーパー | バックヤードの脱臭、殺菌。冷蔵室の移り香防止。作業服の除菌。 |
| 活魚水槽 | 養殖場でのオゾン水循環による病害発生防止。生け簀の残餌分解。水槽のぬめり防止。 |
| 老人ホーム | 居室の除菌、脱臭。浴室湯の循環浄化、脱臭。 |
| 給食センター | 食材のオゾン水洗浄による殺菌。厨房のオゾン殺菌、脱臭。 |
| 飲料水工場 | ペットボトルの無菌充填システム。 |
| 特定事業場 | 下水処理場、ゴミ焼却場、ゴミ処理場、産業廃棄物処理場、し尿処理場等の脱臭。 |
液相適用例
| 対象 | オゾン水濃度(mg/L) | 接触時間(分) |
| 養魚用水 | 0.01~0.05 | 連続 |
| 浴用水 | 0.1~0.5 | 連続 |
| 脱臭 | 0.5~1.0 | 1 |
| 清水の殺菌 | 0.5~1.0 | 5 |
| 清水中の処理品 | 1.0~2.0 | 5 |
| 汚水の殺菌 | 2.0~3.0 | 5 |
| 脱色 | 2.0~3.0 | 5 |
| 有機物除去 | 1.0~3.0 | 5 |
| プール用水 | 0.5~1.0 | 2~5 |
気相適用例
| 区分 | 対象 | 目的 | 濃度(ppm) |
| 流通産業 | 業務用冷凍・冷蔵倉庫・貯蔵庫、運搬車・運搬船 | 食肉・果実・野菜の保冷脱臭 | 0.01~0.5 |
| 食品加工 | 調理室・包装場、更衣室生ゴミ庫、トイレ、野菜洗浄 | 作業環境・調理機器・作業衣のクリーン化(除菌・脱臭) | 0.01~1.0 |
| 病院 | 診察室・待合室、手術室、通路 | 病院内二次感染防止、脱臭 | 0.01~1.0 |
| 畜産業 | 養豚場・養鶏場 | 伝染病予防、臭気除去 | 0.01~1.0 |
| 住宅 | 居室・厨房・ロッカー・トイレ・ペット・し尿浄化槽 | 防虫(ゴキブリ・ダニ・蝿・蚊)ペットの伝染病予防・脱臭・除菌 | 0.01~0.03 |
| 大型建造物 | ゴミ室・トイレ | 脱臭・悪臭除去 | 0.01~0.03 |
| クリーンルーム | 試験研究施設 | - | 0.02~0.5 |
| ガス処理 | 悪臭排出施設 | 分解・酸化による悪臭除去 | 数ppm |
| 燻蒸 | 病院・動物実験室製薬会社、食品工場 | 集中治療室・感染症病室・動物実験施設・医薬品製造室等の強力脱臭・除菌 | 200ppm |
| 製造工業 | 半導体工場 | フォトレジスト除去・CVD・シリコンウエハ洗浄 | 50,000~84,000ppm |
オゾンの人体への影響
オゾンは、その生成過程で毒性のある二次生成物を生成せず(空気を原料とする場合、僅かに窒素酸化物を生成させる)、安全性の高い気体ですが、濃度が極めて高い場合には、強い毒性を示します。これは、オゾンが強い酸化力を持ち、反応性が高いためです。
また、水分に吸収されにくいので、呼吸器系に取り込まれた場合には肺の深部にまで到達して、呼吸器障害(肺水腫等)を引き起こすことが報告されています。通産省や労働省ではまだ確たる使用基準を定めていませんが、日本産業衛生学会:許容濃度委員会や、中央労働災害防止協会は0.1ppmを労働環境における抑制濃度と規定しています。
また、ACGIH(米国労働衛生専門官会議)では、8時間労働におけるオゾン許容濃度を同じく0.1ppmとし、15分以下の短時間曝露の許容濃度を0.3ppmと規定しています。
オゾンの生体に対する影響
| オゾン濃度(ppm) | 影響・作用等 |
| 0.01~0.02 | 臭気を感じる(やがて慣れる)。 |
|---|---|
| 0.1 | 強い臭気、鼻・のどに刺激を感じる。 |
| 0.2~0.5 | 3~6時間で視覚低下の症状が出る。 |
| 0.5 | 明らかに上部気道に刺激を感じる。 |
| 1~2 | 2時間で頭痛、胸部痛、上部気道の渇きと咳が起こる。曝露をくり返すと慢性中毒になる。 |
| 5~10 | 脈拍増加、肺水腫の症状がでる。 |
| 15~20 | 小動物は2時間以内に死亡する。 |
| 50 | 人間も1時間で生命が危険になる。 |
オゾン処理報告書」 日本水道協会 昭和59年8月 40頁より
※実際にオゾンを取り扱う場合、幸いなことにオゾンが毒性を発揮する濃度では強烈な臭いがするため、不本意にその危険状態に長時間さら曝される危険性は極めて少ないと言われています。
オゾンの質量濃度と容量濃度
これまで殺菌に必要なオゾン濃度や人体に影響を与えるオゾン濃度などを表わす場合に、すべてppmという単位で述べてきました。これは容量濃度と呼ばれるもので、ppmとはpartspermilionの略で百万分率を表します。つまり、ある量が全体の百万分の幾つを占めるかを表し、主として体積に用いられます。
一般的には、最近話題のダイオキシンのように大気汚染や水質汚濁物質の濃度を示すのに用いられていることはご承知の通りで、大気1,000リットル=1m3当たりの汚染気体のミリリットル数を表します。言え変えれば1m3=1,000,000ccの空気の中に1ccの別の気体を含んでいる場合の濃度が1ppmです。
水の場合にはmg/L、つまり、水1リットル=1,000グラム当たりのミリグラム数を言います。これは、1,000グラムの水の中に、1/1,000グラムの他の液体を含むときの濃度が、1ppmであるということです。
一方質量濃度は、大気の場合1m3当たり何ミリグラムになるかで示します。オゾンの場合には質量濃度(mg/m3)と容量濃度(ppm)の間には、0℃1気圧において次の関係が成立します。
容量濃度(ppm)=1.0mg/m3×(X+273)/273×オゾンの1モル量(0℃ 1気圧に於いて)/オゾンの分子量
ここで 273=絶対温度X=気温℃ を表わします。
オゾンの分子量=48
1モルの容積=22.4L(0℃ 760mHg=1気圧の時) ですから
・室内の気温を20℃とした場合
容量濃度(ppm)=1.0×(20+273)/273×22.4/48=0.5ppm となります。
これは言うまでもなく、1.0m×1.0m×1.0m=1.0m3の容積に1.0mgのオゾンを入れると0.5ppmの濃度になるということです。
※人体が安全に作業できるオゾン濃度の上限は0.1ppmですから、オゾンの質量濃度は、この1/5の0.2mg/m3ということになります。
実際には、オゾンの半減期、空気の換気回数、処理対象との反応スピードなどを考慮して、システム設計上の安全率を決め、注入オゾン量を決めます。
例えば、先に述べましたように加工工場の夜間の雰囲気濃度は0.3~20ppmが目安ですが、これを0.5ppmと設定して、システムの安全率を10倍にとるとすれば、10.0mg/m3のオゾンが必要であり、処理時間を1時間と設定した場合には、10.0mg/m3/hrのオゾンが必要になります。
オゾンゼネレータ OZ-100Pのオゾン発生量は、100.0mg/hr(MAX)ですから、この場合1時間では10m3の空間の殺菌処理が出来ることになります。
殺菌に要するオゾン量のシステムの安全率を決めるのは、建物の構造、気温、湿度、換気回数、室内空気の循環方法など多くの要素が絡みますので、慎重を要します。
まとめ
下表に一般的なオゾン利用の利点と課題をまとめてみました。
| 利点 | ・オゾンは天然自然物である。 |
|---|---|
| 課題 | 1. 製造コストが高い。 |
欠点の1.の製造コストについては、高効率なオゾンゼネレータの開発によって解決に近づいており、2.および3.の欠点は、環境インパクトが小さい点では逆に長所でもあります。最近、オゾンの幅広い有効性が認められると同時に、新規参入する企業が増えているといわれます。
しかし、実際にオゾンを有効に利用するためには、オゾンに対する幅広い知識と経験の積み重ねが必要です。技術的な裏づけのないオゾン利用は、ユーザーにオゾンの有効性について疑問を抱かせる結果になる恐れがあります。特に人体や生体に直接オゾンを利用する場合などは、安全性について十分に検討する慎重さが必要です。